Menu

Polimorfizm genu MTHFR i jego znaczenie kliniczne
Hubert Salamaga. Tadeusz Pietrucha. Instytut Genomiki i Medycyny Molekularnej, Centrum Medycyny Spersonalizowanej CODE sp. z o.o., Łódź.
Białko reduktaza 5,10-metylenotetrahydrofolianowa (MTHFR, EC 1.5.1.20) jest enzymem katalizującym reakcję prowadzącą do powstania 5-metylotetrahydrofolianu, będącego pochodną kwasu foliowego najczęściej występującą we krwi [1], niezbędnego w reakcji przekształcenia homocysteiny do metioniny (ryc.1.). Warianty sekwencyjne genu kodującego MTHFR mogą prowadzić do wzrostu stężenia homocysteiny we krwi.
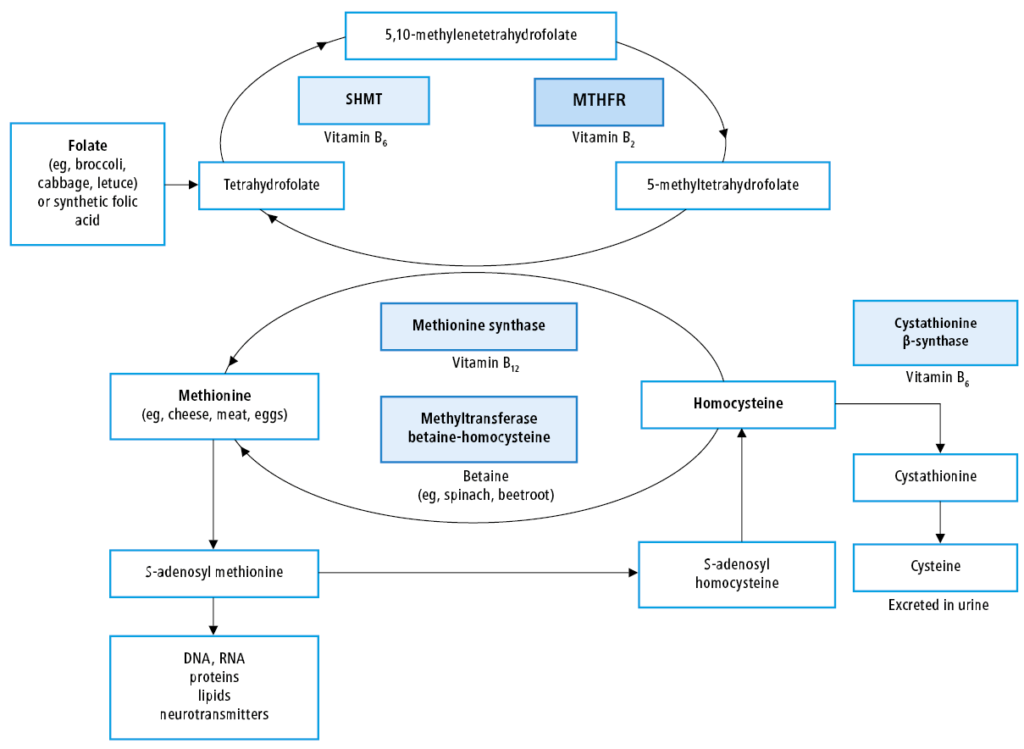
Ryc.1. Rola reduktazy 5,10-metylenotetrahydrofolianu (MTHFR – 5,10‐methylenetetrahydrofolate reductase) w metabolizmie komórkowym [6]
Dwa najczęściej przewijające się w literaturze naukowej warianty w obrębie genu MTHFR to c.677C>T oraz c.1298A>C.
W przypadku zmienności w pozycji c.677C>T, heterozygoty C/T wykazują obniżoną aktywność enzymu o ok. 40 %, u homozygot (T/T) natomiast aktywność enzymu MTHFR spada aż o 70% [6].
Skutkuje to wzrostem stężenia homocysteiny we krwi, która negatywnie oddziałuje m.in. na proces hemostazy zwiększając ryzyko powikłań zakrzepowych oraz może również wpływać na zdolność prokreacji. Stężenie homocysteiny we krwi powyżej 15 mmol/l jest wskaźnikiem hiperhomocysteinemii. Witaminy z grupy B i kwas foliowy zmniejszają stężenie homocysteiny we krwi o ok. 25% [6].
Wystąpienie zmienności w pozycji c.1298A>C genu MTHFR nie ma aż tak drastycznych skutków dla aktywności enzymu jak w przypadku c.677C>T; dla heterozygot jest to 10% redukcja aktywności, a dla homozygot (C/C) ok. 40% [6].
Oba wymienione polimorfizmy na przestrzeni lat były wiązane z szeroką gamą schorzeń takich jak niepłodność męska, komplikacje w przebiegu ciąży, defekty cewy nerwowej, zakrzepica żylna [1,5,6,7]. Wyniki badań przeprowadzonych w kierunku weryfikacji wpływu tych polimorfizmów na częstość i dotkliwość tych schorzeń często przeczą sobie nawzajem.
W roku 2020 przeprowadzono dwie metaanalizy, mające na celu określić wpływ obu wyżej wymienionych polimorfizmów na wystąpienie niepłodności męskiej [8,9].
W przypadku analizy przeprowadzonej przez Han LJ i wsp. [9] ostatecznie pod uwagę wzięto łącznie 62 badania; 59 z nich dotyczyło zmienności 677C>T, a 28 1298A>C. Po przeprowadzeniu odpowiednich operacji statystycznych wyniki metaanalizy w przypadku 677C>T wskazywały, że osoby posiadające przynajmniej jeden allel T w pozycji 677 genu MTHFR były 1.38 razy bardziej narażone na wystąpienie niepłodności. W przypadku porównania homozygot TT do CC ryzyko to wzrosło do 1.77 [9]. Wyniki jakie uzyskano w przypadku zmienności w pozycji 1298A>C nie wykazywały istotnego statystycznie wzrostu ryzyka niepłodności męskiej w populacji ogólnej. Jednakże w przypadku subpopulacji wschodnio-azjatyckiej wydaje się, że pewien związek pomiędzy polimorfizmem genu MTHFR a ryzykiem niepłodności istnieje. Wen-Jie Huang i wsp. [11] wykazali, że podawanie kwasu foliowego przez 3 miesiące (0,8 mg dziennie) pacjentom cierpiącym na oligozoospermię będących jednocześnie nosicielami polimorficznego genu MTHFR, znacząco polepszało parametry nasienia, a tym samym zwiększało szansę sukcesu prokreacyjnego.
Alikabari i wsp.[8] również przeanalizowali oba warianty sekwencyjne genu MTHFR. 34 wybrane badania dotyczyły 677C>T, a 22 badania uwzględniały 1298A>C. Po odpowiedniej obróbce statystycznej dane dotyczące pierwszego z polimorfizmów wskazywały, że wystąpienie przynajmniej jednego z alleli T prowadziło do wzrostu ryzyka wystąpienia niepłodności 1.37 razy. Gdy porównano homozygoty ryzyko u nosicieli TT było 1.62 razy większe. Tak jak w przypadku analizy przeprowadzonej przez Han LJ [9] nie wykazano związku polimorfizmu 1298A>C z niepłodnością męską.
Do komplikacji związanych z przebiegiem ciąży zalicza się: utratę ciąży, odklejenie łożyska i stan przedrzucawkowy. Wu i wsp. [7] przeprowadzili metaanalizę w kierunku określenia wpływu polimorfizmu c.677C>T na nawracającą utratę ciąży. Łącznie przeanalizowani 27 publikacji dotyczących badań kobiet u których doszło do poronienia w przynajmniej dwóch przypadkach. Gdy porównano nosicieli alleli T z kobietami o genotypie CC każda populacja wykazywała zwiększone ryzyko utraty ciąży (1.231 razy większe) z wyjątkiem kobiet z grupy etnicznej kaukaskiej, u których wynik mimo, iż wskazujący na wzrost ryzyka nie był istotny statystycznie.
Artykuł przeglądowy autorów Schwahn B i Rozen R [10], dotyczący efektów polimorfizmu genu MTHFR i ich skutków klinicznych omawia wyniki badania wskazującego na 3,3 krotnie większe ryzyko wystąpienia utraty ciąży, 2,2 razy większe ryzyko oderwania łożyska i 2,6 razy większe ryzyko wystąpienia stanu przedrzucawkowego u kobiet będących homozygotami T/T. Dwie metaanalizy przywołane w tym artykule wskazują jednak nieco mniejsze skutki polimorfizmu genu MTHFR: 1,4 razy większe ryzyko utraty ciąży i 2 razy większe wystąpienia stanu przedrzucawkowego. Autorzy spekulują, że różnica w uzyskanych wynikach może wynikać z niewziętego pod uwagę występowania mutacji w obrębie innych genów takich jak gen czynnika V lub protrombiny.
Wskazaniami najczęściej skłaniającymi lekarzy do badania wariantów sekwencyjnych genu MTHFR c.677C>T i c.1298A>C są [6]:
– nawracające lub niesprowokowane (uraz, zabieg chirurgiczny, antykoncepcja hormonalna, ciąża itp.) incydenty zakrzepicy żylnej lub zatorowości płucnej;
– powikłania położnicze, najczęściej nawracające poronienia lub nawet jednorazowa utrata ciąży, najczęściej w I trymestrze ciąży.
Stanowisko Polskiego Towarzystwa Genetyki Człowieka i Polskiego Towarzystwa Ginekologów i Położników w sprawie znaczenia diagnostycznego badania wariantów sekwencyjnych genu MTHFR c.677C>T i c.1298A>C jest sceptyczne [12].
Literatura:
- Hickey SE, Curry CJ, Toriello HV. ACMG practice guideline: Lack of evidence for MTHFR polymorphism testing. Genet Med 2013;15(2):153–56
- Trimmer EE. Methylenetetrahydrofolate reductase: biochemical characterization and medical significance. Curr Pharm Des. 2013;19(14):2574-93. doi: 10.2174/1381612811319140008. PMID: 23116396.
- Födinger M, Hörl WH, Sunder-Plassmann G. Molecular biology of 5,10-methylenetetrahydrofolate reductase. J Nephrol. 2000 Jan-Feb;13(1):20-33. PMID: 10720211.
- Rotondo JC, Bosi S, Bazzan E, Di Domenico M, De Mattei M, Selvatici R, Patella A, Marci R, Tognon M, Martini F. Methylenetetrahydrofolate reductase gene promoter hypermethylation in semen samples of infertile couples correlates with recurrent spontaneous abortion. Hum Reprod. 2012 Dec;27(12):3632-8. doi: 10.1093/humrep/des319. Epub 2012 Sep 25. PMID: 23010533.
- Rotondo JC, Selvatici R, Di Domenico M, Marci R, Vesce F, Tognon M, Martini F. Methylation loss at H19 imprinted gene correlates with methylenetetrahydrofolate reductase gene promoter hypermethylation in semen samples from infertile males. Epigenetics. 2013 Sep;8(9):990-7. doi: 10.4161/epi.25798. Epub 2013 Jul 24. PMID: 23975186; PMCID: PMC3883776.
- Undas A, Chojnowski K, Klukowska A, Łętowska M, Mital A, Młynarski W, Musiał J, Podolak-Dawidziak M, Sąsiadek M, Treliński J, Urasiński T, Windyga J, Zdziarska J, Zawilska K. Determination and interpretation of MTHFR gene mutations in gynecology and internal medicine. Pol Arch Intern Med. 2019 Oct 30;129(10):728-732. doi: 10.20452/pamw.15039. Epub 2019 Oct 30. PMID: 31670725.
- Wu, X., Zhao, L., Zhu, H., He, D., Tang, W., & Luo, Y. (2012). Association Between the MTHFR C677T Polymorphism and Recurrent Pregnancy Loss: A Meta-Analysis. Genetic Testing and Molecular Biomarkers, 16(7), 806–811. doi:10.1089/gtmb.2011.0318
- Aliakbari F, Pouresmaeili F, Eshghifar N, Zolghadr Z, Azizi F. Association of the MTHFR 677C>T and 1298A>C polymorphisms and male infertility risk: a meta-analysis. Reprod Biol Endocrinol. 2020 Sep 10;18(1):93. doi: 10.1186/s12958-020-00649-1. PMID: 32912251; PMCID: PMC7488080.
- Han LJ, He XF, Ye XH. Methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and male infertility risk: An updated meta-analysis. Medicine (Baltimore). 2020 Dec 18;99(51):e23662. doi: 10.1097/MD.0000000000023662. PMID: 33371103; PMCID: PMC7748209.
- Schwahn B, Rozen R. Polymorphisms in the methylenetetrahydrofolate reductase gene: clinical consequences. Am J Pharmacogenomics. 2001;1(3):189-201. doi: 10.2165/00129785-200101030-00004. PMID: 12083967.
- Wen-Jie Huang, Xi-Lan Lu, Jun-Tao Li and Jian-Min Zhang. Effects of folic acid on oligozoospermia with MTHFR polymorphisms in term of seminal parameters, DNA fragmentation, and live birth rate: a double-blind, randomized, placebo-controlled trial.
Andrology, 2020, 8, 110–116. - Hanna Moczulska, Karolina Pesz, Agnieszka Gach, Maciej Borowiec, Piotr Sieroszewski, Maria Sąsiadek, Lucjusz Jakubowski, Mirosław Wielgoś. Stanowisko ekspertów Polskiego Towarzystwa Genetyki Człowieka i Polskiego Towarzystwa Ginekologów i Położników w sprawie zlecania i interpretacji wyników badań pod kątem wariantów genetycznych w genie MTHFR. Ginekologia i Perinatologia Praktyczna 2017;2(5):234-238.
MASZ WĄTPLIWOŚCI/PYTANIA, ZADAJ JE PONIŻEJ, A MY PO KONSULTACJI ZE SPECJALISTAMI ODPOWIEMY NA TWOJE PYTANIE!
Menu

Polimorfizm genu MTHFR i jego znaczenie kliniczne

Hubert Salamaga. Tadeusz Pietrucha. Instytut Genomiki i Medycyny Molekularnej, Centrum Medycyny Spersonalizowanej CODE sp. z o.o., Łódź.
Białko reduktaza 5,10-metylenotetrahydrofolianowa (MTHFR, EC 1.5.1.20) jest enzymem katalizującym reakcję prowadzącą do powstania 5-metylotetrahydrofolianu, będącego pochodną kwasu foliowego najczęściej występującą we krwi [1], niezbędnego w reakcji przekształcenia homocysteiny do metioniny (ryc.1.). Warianty sekwencyjne genu kodującego MTHFR mogą prowadzić do wzrostu stężenia homocysteiny we krwi.

Ryc.1. Rola reduktazy 5,10-metylenotetrahydrofolianu (MTHFR – 5,10‐methylenetetrahydrofolate reductase) w metabolizmie komórkowym [6]
Dwa najczęściej przewijające się w literaturze naukowej warianty w obrębie genu MTHFR to c.677C>T oraz c.1298A>C.
W przypadku zmienności w pozycji c.677C>T, heterozygoty C/T wykazują obniżoną aktywność enzymu o ok. 40 %, u homozygot (T/T) natomiast aktywność enzymu MTHFR spada aż o 70% [6].
Skutkuje to wzrostem stężenia homocysteiny we krwi, która negatywnie oddziałuje m.in. na proces hemostazy zwiększając ryzyko powikłań zakrzepowych oraz może również wpływać na zdolność prokreacji. Stężenie homocysteiny we krwi powyżej 15 mmol/l jest wskaźnikiem hiperhomocysteinemii. Witaminy z grupy B i kwas foliowy zmniejszają stężenie homocysteiny we krwi o ok. 25% [6].
Wystąpienie zmienności w pozycji c.1298A>C genu MTHFR nie ma aż tak drastycznych skutków dla aktywności enzymu jak w przypadku c.677C>T; dla heterozygot jest to 10% redukcja aktywności, a dla homozygot (C/C) ok. 40% [6].
Oba wymienione polimorfizmy na przestrzeni lat były wiązane z szeroką gamą schorzeń takich jak niepłodność męska, komplikacje w przebiegu ciąży, defekty cewy nerwowej, zakrzepica żylna [1,5,6,7]. Wyniki badań przeprowadzonych w kierunku weryfikacji wpływu tych polimorfizmów na częstość i dotkliwość tych schorzeń często przeczą sobie nawzajem.
W roku 2020 przeprowadzono dwie metaanalizy, mające na celu określić wpływ obu wyżej wymienionych polimorfizmów na wystąpienie niepłodności męskiej [8,9].
W przypadku analizy przeprowadzonej przez Han LJ i wsp. [9] ostatecznie pod uwagę wzięto łącznie 62 badania; 59 z nich dotyczyło zmienności 677C>T, a 28 1298A>C. Po przeprowadzeniu odpowiednich operacji statystycznych wyniki metaanalizy w przypadku 677C>T wskazywały, że osoby posiadające przynajmniej jeden allel T w pozycji 677 genu MTHFR były 1.38 razy bardziej narażone na wystąpienie niepłodności. W przypadku porównania homozygot TT do CC ryzyko to wzrosło do 1.77 [9]. Wyniki jakie uzyskano w przypadku zmienności w pozycji 1298A>C nie wykazywały istotnego statystycznie wzrostu ryzyka niepłodności męskiej w populacji ogólnej. Jednakże w przypadku subpopulacji wschodnio-azjatyckiej wydaje się, że pewien związek pomiędzy polimorfizmem genu MTHFR a ryzykiem niepłodności istnieje. Wen-Jie Huang i wsp. [11] wykazali, że podawanie kwasu foliowego przez 3 miesiące (0,8 mg dziennie) pacjentom cierpiącym na oligozoospermię będących jednocześnie nosicielami polimorficznego genu MTHFR, znacząco polepszało parametry nasienia, a tym samym zwiększało szansę sukcesu prokreacyjnego.
Alikabari i wsp.[8] również przeanalizowali oba warianty sekwencyjne genu MTHFR. 34 wybrane badania dotyczyły 677C>T, a 22 badania uwzględniały 1298A>C. Po odpowiedniej obróbce statystycznej dane dotyczące pierwszego z polimorfizmów wskazywały, że wystąpienie przynajmniej jednego z alleli T prowadziło do wzrostu ryzyka wystąpienia niepłodności 1.37 razy. Gdy porównano homozygoty ryzyko u nosicieli TT było 1.62 razy większe. Tak jak w przypadku analizy przeprowadzonej przez Han LJ [9] nie wykazano związku polimorfizmu 1298A>C z niepłodnością męską.
Do komplikacji związanych z przebiegiem ciąży zalicza się: utratę ciąży, odklejenie łożyska i stan przedrzucawkowy. Wu i wsp. [7] przeprowadzili metaanalizę w kierunku określenia wpływu polimorfizmu c.677C>T na nawracającą utratę ciąży. Łącznie przeanalizowani 27 publikacji dotyczących badań kobiet u których doszło do poronienia w przynajmniej dwóch przypadkach. Gdy porównano nosicieli alleli T z kobietami o genotypie CC każda populacja wykazywała zwiększone ryzyko utraty ciąży (1.231 razy większe) z wyjątkiem kobiet z grupy etnicznej kaukaskiej, u których wynik mimo, iż wskazujący na wzrost ryzyka nie był istotny statystycznie.
Artykuł przeglądowy autorów Schwahn B i Rozen R [10], dotyczący efektów polimorfizmu genu MTHFR i ich skutków klinicznych omawia wyniki badania wskazującego na 3,3 krotnie większe ryzyko wystąpienia utraty ciąży, 2,2 razy większe ryzyko oderwania łożyska i 2,6 razy większe ryzyko wystąpienia stanu przedrzucawkowego u kobiet będących homozygotami T/T. Dwie metaanalizy przywołane w tym artykule wskazują jednak nieco mniejsze skutki polimorfizmu genu MTHFR: 1,4 razy większe ryzyko utraty ciąży i 2 razy większe wystąpienia stanu przedrzucawkowego. Autorzy spekulują, że różnica w uzyskanych wynikach może wynikać z niewziętego pod uwagę występowania mutacji w obrębie innych genów takich jak gen czynnika V lub protrombiny.
Wskazaniami najczęściej skłaniającymi lekarzy do badania wariantów sekwencyjnych genu MTHFR c.677C>T i c.1298A>C są [6]:
– nawracające lub niesprowokowane (uraz, zabieg chirurgiczny, antykoncepcja hormonalna, ciąża itp.) incydenty zakrzepicy żylnej lub zatorowości płucnej;
– powikłania położnicze, najczęściej nawracające poronienia lub nawet jednorazowa utrata ciąży, najczęściej w I trymestrze ciąży.
Stanowisko Polskiego Towarzystwa Genetyki Człowieka i Polskiego Towarzystwa Ginekologów i Położników w sprawie znaczenia diagnostycznego badania wariantów sekwencyjnych genu MTHFR c.677C>T i c.1298A>C jest sceptyczne [12].
Literatura:
- Hickey SE, Curry CJ, Toriello HV. ACMG practice guideline: Lack of evidence for MTHFR polymorphism testing. Genet Med 2013;15(2):153–56
- Trimmer EE. Methylenetetrahydrofolate reductase: biochemical characterization and medical significance. Curr Pharm Des. 2013;19(14):2574-93. doi: 10.2174/1381612811319140008. PMID: 23116396.
- Födinger M, Hörl WH, Sunder-Plassmann G. Molecular biology of 5,10-methylenetetrahydrofolate reductase. J Nephrol. 2000 Jan-Feb;13(1):20-33. PMID: 10720211.
- Rotondo JC, Bosi S, Bazzan E, Di Domenico M, De Mattei M, Selvatici R, Patella A, Marci R, Tognon M, Martini F. Methylenetetrahydrofolate reductase gene promoter hypermethylation in semen samples of infertile couples correlates with recurrent spontaneous abortion. Hum Reprod. 2012 Dec;27(12):3632-8. doi: 10.1093/humrep/des319. Epub 2012 Sep 25. PMID: 23010533.
- Rotondo JC, Selvatici R, Di Domenico M, Marci R, Vesce F, Tognon M, Martini F. Methylation loss at H19 imprinted gene correlates with methylenetetrahydrofolate reductase gene promoter hypermethylation in semen samples from infertile males. Epigenetics. 2013 Sep;8(9):990-7. doi: 10.4161/epi.25798. Epub 2013 Jul 24. PMID: 23975186; PMCID: PMC3883776.
- Undas A, Chojnowski K, Klukowska A, Łętowska M, Mital A, Młynarski W, Musiał J, Podolak-Dawidziak M, Sąsiadek M, Treliński J, Urasiński T, Windyga J, Zdziarska J, Zawilska K. Determination and interpretation of MTHFR gene mutations in gynecology and internal medicine. Pol Arch Intern Med. 2019 Oct 30;129(10):728-732. doi: 10.20452/pamw.15039. Epub 2019 Oct 30. PMID: 31670725.
- Wu, X., Zhao, L., Zhu, H., He, D., Tang, W., & Luo, Y. (2012). Association Between the MTHFR C677T Polymorphism and Recurrent Pregnancy Loss: A Meta-Analysis. Genetic Testing and Molecular Biomarkers, 16(7), 806–811. doi:10.1089/gtmb.2011.0318
- Aliakbari F, Pouresmaeili F, Eshghifar N, Zolghadr Z, Azizi F. Association of the MTHFR 677C>T and 1298A>C polymorphisms and male infertility risk: a meta-analysis. Reprod Biol Endocrinol. 2020 Sep 10;18(1):93. doi: 10.1186/s12958-020-00649-1. PMID: 32912251; PMCID: PMC7488080.
- Han LJ, He XF, Ye XH. Methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and male infertility risk: An updated meta-analysis. Medicine (Baltimore). 2020 Dec 18;99(51):e23662. doi: 10.1097/MD.0000000000023662. PMID: 33371103; PMCID: PMC7748209.
- Schwahn B, Rozen R. Polymorphisms in the methylenetetrahydrofolate reductase gene: clinical consequences. Am J Pharmacogenomics. 2001;1(3):189-201. doi: 10.2165/00129785-200101030-00004. PMID: 12083967.
- Wen-Jie Huang, Xi-Lan Lu, Jun-Tao Li and Jian-Min Zhang. Effects of folic acid on oligozoospermia with MTHFR polymorphisms in term of seminal parameters, DNA fragmentation, and live birth rate: a double-blind, randomized, placebo-controlled trial.
Andrology, 2020, 8, 110–116. - Hanna Moczulska, Karolina Pesz, Agnieszka Gach, Maciej Borowiec, Piotr Sieroszewski, Maria Sąsiadek, Lucjusz Jakubowski, Mirosław Wielgoś. Stanowisko ekspertów Polskiego Towarzystwa Genetyki Człowieka i Polskiego Towarzystwa Ginekologów i Położników w sprawie zlecania i interpretacji wyników badań pod kątem wariantów genetycznych w genie MTHFR. Ginekologia i Perinatologia Praktyczna 2017;2(5):234-238.
MASZ WĄTPLIWOŚCI/PYTANIA, ZADAJ JE PONIŻEJ, A MY PO KONSULTACJI ZE SPECJALISTAMI ODPOWIEMY NA TWOJE PYTANIE!


